Статьи. Наука и практика.
Реология крови
Реология крови (от греческого слова rheos – течение, поток) – текучесть крови, определяемая совокупностью функционального состояния форменных элементов крови (подвижность, деформируемость, агрегационная активность эритроцитов, лейкоцитов и тромбоцитов), вязкости крови (концентрация белков и липидов), осмолярности крови (концентрация глюкозы). Ключевая роль в формировании реологических параметров крови принадлежит форменным элементам крови, прежде всего эритроцитам, которые составляют 98% от общего объема форменных элементов крови. [2,6,11].
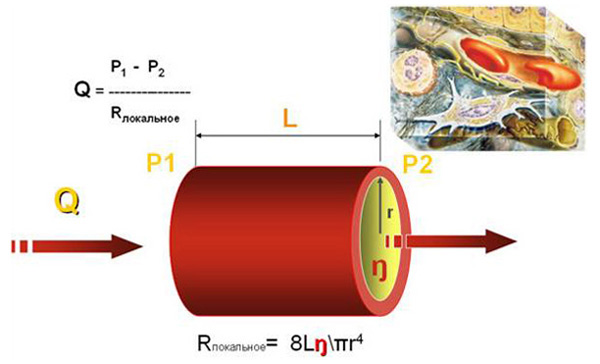
Прогрессирование любого заболевания сопровождается функуционально-структурными изменениями тех или иных форменных элементов крови. Особый интерес вызывают изменения эритроцитов, мембраны которых являются моделью молекулярной организации плазматических мембран. От структурной организации мембран красных кровяных клеток во многом зависят их агрегационная активность и деформируемость, являющиеся важнейшими компонентами в микроцеркуляции.[3,11,13] Вязкость крови является одной из интегральных характеристик микроциркуляции, существенно влияющих на гемодинамические параметры. Долевое участие вязкости крови в механизмах регуляции артериального давления и органной перфузии отражается законом Пуазейля: МОоргана= (Рарт – Рвен)/ Rлок, где Rлок= 8Lh / pr4, L – длина сосуда, h - вязкость крови, r – диаметр сосуда. (Рис.1).
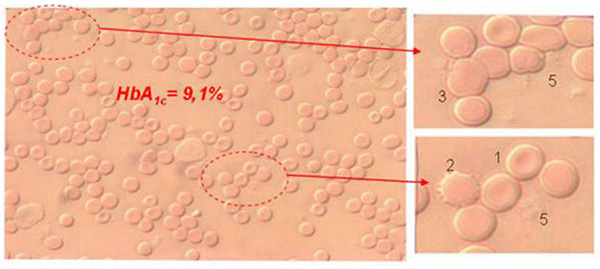
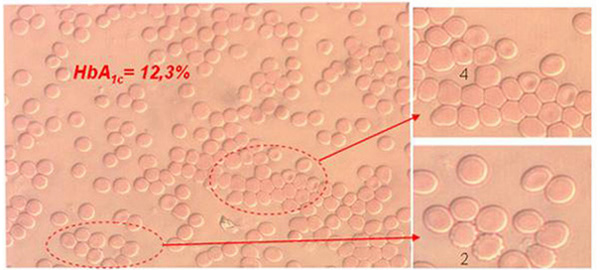
Большое количество клинических работ, посвященных гемореологии крови при сахарном диабете (СД) и метаболическом синдроме (МС), выявили снижение параметров, характеризующих деформируемость эритроцитов. У больных СД пониженная способность эритроцитов к деформации и их повышенная вязкость являются следствием увеличения количества гликозированного гемоглобина (HbА1с). Высказано предположение, что связанное с этим затруднение кровообращения в капиллярах и изменение давления в них стимулирует утолщение базальной мембраны, ведет к снижению коэффициента доставки кислорода к тканям, т.е. аномальные эритроциты играют триггерную роль в развитие диабетической ангиопатии.[2,3,6,11,13].
HbА1с, по данным различных авторов, составляет 4 – 6% общего количества Hb в крови здоровых людей, тогда как у больных СД уровень HbА1с. в 2 – 3 раза выше.
Нормальный эритроцит в обычных условиях имеет двояковогнутую форму диска, за счет чего площадь его поверхности больше на 20% в сравнении с сферой того же объема. Нормальные эритроциты способны значительно деформироваться при прохождении через капилляры, при этом не меняя своего объема и площади поверхности, что поддерживает процессы диффузии газов на высоком уровне на протяжении всего микроциркуляторного русла различных органов. Показано, что при высокой деформируемости эритроцитов происходит максимальный перенос кислорода в клетки, а при ухудшении деформируемости (повышение жесткости) – поступление кислорода в клетки резко снижается, тканевое рО2 падает.[2,3,13]
Деформируемость является важнейшим свойством эритроцитов, обусловливающим их способность выполнять транспортную функцию. Это способность эритроцитов изменять свою форму при постоянном объеме и площади поверхности позволяет им приспосабливаться к условиям кровотока в системе микроциркуляции. Деформируемость эритроцитов обусловлена такими факторами, как внутренняя вязкость (концентрация внутриклеточного гемоглобина), клеточная геометрия (поддержание формы двояковогнутого диска, объем, отношение поверхности к объему) и свойствами мембраны, которые обеспечивают форму и эластичность эритроцитов.
Деформируемость во многом зависит от степени сжимаемости липидного бислоя и постоянством его взаимосвязи с белковыми структурами клеточной мембраны.
Эластические и вязкостные свойства мембраны эритроцитов определяются состоянием и взаимодействием белков цитоскелета, интегральных белков, оптимальным содержанием АТФ, ионов Са++, Mg++ и концентрацией гемоглобина, которые обуславливают внутреннюю текучесть эритроцита. К факторам повышающим жесткость мембран эритроцитов относятся: образование стойких соединений гемоглобина с глюкозой, повышение концентрации в них холестерина и увеличение концентрации свободного Са++ и АТФ в эритроците.
Нарушение деформируемости эритроцитов имеют место при изменении липидного спектра мембран и, прежде всего, при нарушении соотношения холестерин/фосфолипиды, а также при наличие продуктов повреждения мембраны в результате перекисного окисления липидов (ПОЛ). Продукты ПОЛ оказывают дестабилизирующее воздействие на структурно – функциональное состояние эритроцитов и способствуют их модификации.
Деформируемость эритроцитов снижается в связи с абсорбцией на поверхности эритроцитарных мембран белков плазмы, прежде всего, фибриногена. Это включает в себя изменения мембран самих эритроцитов, снижение поверхностного заряда эритроцитарной мембраны, изменение формы эритроцитов и изменений со стороны плазмы (концентрация белков, липидного спектра, уровня общего холестерина, фибриногена, гепарина). Повышенная агрегация эритроцитов приводит к нарушению транскаппилярного обмена, выбросу БАВ, стимулирует адгезию и агрегацию тромбоцитов.
Ухудшение деформируемости эритроцитов сопровождает активацию процессов ПОЛ и снижение концентрации компонентов антиоксидантной системы при различных стрессорных ситуациях или заболеваниях, в частности при СД и сердечно-сосудистых.
Актвация свободнорадикальных процессов обуславливает нарушения гемореологических свойств, реализуемые через повреждения циркулирующих эритроцитов (окисление мембранных липидов, повышение жесткости билипидного слоя, гликозилирование и агрегация белков мембраны), оказывая опосредованное влияние на другие показатели кислородотранспортной функции крови и транспорт кислорода в ткани. Значительная и продолжающаяся активация ПОЛ в сыворотке привод к снижению деформируемости эритроцитов и увеличению их арегации. Таким образом эритроциты одни из первых реагируют на активацию ПОЛ вначале увеличением деформируемости эритроцитов, а затем по мере накопления продуктов ПОЛ и истощения антиоксидантной защиты к увеличению жесткости мембран эритроцитов, их агрегационной активности и, соответственно, к изменениям вязкости крови.[2,6,13]
Кислородосвязывающие свойства крови играют важную роль в физиологических механизмах поддержания равновесия между процессами свободнорадикального окисления и антиоксидантной защиты в организме. Указанные свойства крови определяют характер и величину диффузии кислорода к тканям в зависимости от потребности в нем и эффективности его использования, вносит вклад в прооксидантно-антиоксидантноне состояние, проявляя в различных ситуациях либо антиоксиданьные либо прооксидантные качества. [2,13]
Таким образом, деформируемость эритроцитов является не только определяющим фактором транспорта кислорода к периферическим тканям и обеспечения их потребности в нем, но и механизмом оказывающим влияние на эффективность функционирования антиоксидантной защиты и, в конечном итоге, всей организации поддержания прооксидантно-антиоксидантного равновесия всего организма.
При инсулинорезистентности (ИР) отмечено увеличение количества зритроцитов в периферической крови. При этом происходит повышенная агрегация эритроцитов за счет увеличения количества макромолекул адгезии и отмечается снижение деформируемости эритроцитов, несмотря на то, что инсулин в физиологических концентрациях значительно улучшает реологические свойства крови.
В настоящее время широкое распространение получила теория, рассматривающая мембранные нарушения как ведущие причины органного проявления различных заболевания, в частности в патогенез артериальной гипертензии при МС.
Эти изменения происходят и в различных типах клеток крови: эритроцитах, тромбоцитах, лимфоцитах. [6,10].
Внутриклеточное перераспределение кальция в тромбоцитах и эритроцитах влечет за собой повреждение микротубол, активацию контрактильной системы, реакцию высвобождения биологически активных веществ (БАВ) из тромбоцитов, запуская их адгезию, агрегацию, локальную и системную вазокнстрикцию (тромбоксан А2).
У больных АГ, изменения эластических свойств эритроцитарных мембран сопровождается снижением их поверхностного заряда с последующим образованием эритроцитарных агрегатов. Максимальная скорость спонтанной агрегации с образованием стойких эритроцитарных агрегатов отмечена у больных АГ III степени с осложненным течением заболевания. Спонтанная агрегация эритроцитов усиливает выделение внутриэритроцитарного АДФ с последующим гемолизом, что вызывает сопряженную тромбоцитарную агрегацию. Гемолиз эритроцитов в системе микроциркуляции может быть так же связан с нарушением деформируемости эритроцитов, как лимитирующего фактора продолжительности их жизни.
Особенно существенные изменения формы эритроцитов наблюдаются в микроциркуляторном русле, некоторые капилляры которого имеют диаметр менее 2 мкм. Прижизненная микроскопия крови (прим. нативной крови) показывает, что эритроциты, движущиеся в капилляре, подвергаются значительной деформации, приобретая при этом различные формы.[2,3,6].
У больных АГ сочетающейся с СД было выявлено увеличение количества аномальных форм эритроцитов: эхиноцитов, стомацитов, сфероцитов и старых эритроцитов в сосудистом русле.
Большой вклад в гемореологию вносят лейкоциты. В связи с их низкой способностью к деформации, лейкоциты могут депонироваться на уровне микроциркуляторного русла и значимо влиять на ОПСС.
Тромбоциты занимают важное место в клеточно – гуморальном взаимодействии систем гемостаза. Данные литературы свидетельствуют о нарушении функциональной активности тромбоцитов уже на ранней стадии АГ, что проявляется повышением их агрегационной активности, повышением чувствительности к индукторам агрегации.
Исследователями отмечено качественное изменение тромбоцитов у больных АГ под действием увеличения свободного кальция в плазме крови, что коррелирует с величиной систолического и диастолического АД. Электронно – микроскопическое исследование тромбоцитов больных АГ выявило наличие различных морфологических форм тромбоцитов, вызванных их повышенной активацией. Наиболее характерны такие изменения формы как псевдоподиальный и гиалиновый тип. Отмечена высокая корреляционная связь между увеличением количества тромбоцитов с их измененной формой и частотой тромботических осложнений. У больных МС с АГ выявляется увеличение циркулирующих в крови тромбоцитарных агрегатов. [2,6,10,13].
Дислипидемия вносит существенный вклад в функциональную гиперактивность тромбоцитов. Увеличение содержания ОХС, ЛПНП и ЛПОНП при гиперхолестеринемии вызывают патологическое усиление выделения тромбоксана А2 с повышением агрегабельности тромбоцитов. Это связано с наличием на поверхности тромбоцитов рецепторов липопротеинов апо – В и апо – Е. С другой стороны ЛПВП снижают продукцию тромбоксана, ингибируя агрегацию тромбоцитов, за счет связывания со специфическими рецепторами.
Артериальная гипертензия при МС детерминирована множеством взаимодействующих метаболических, нейрогуморальных, гемодинамических факторов и функциональным состоянием форменных элементов крови. Нормализация уровней АД возможно обусловлена суммарными положительными сдвигами в показателях биохимических и реологических параметров крови.
Гемодинамическую основу АГ при МС составляют нарушение соотношения между сердечным выбросом и ОПСС. Сначала возникают функциональные изменения сосудов, связанные с изменениями реологии крови, трансмурального давления и вазоконстрикторными реакциями в ответ на нейрогуморальную стимуляцию, затем формируются морфологические изменения сосудов микроциркуляции лежащие в основе их ремоделирования. При повышении АД снижается дилатационный резерв артериол, поэтому при увеличении вязкости крови ОПСС изменяются в большей степени, чем в физиологических условиях. Если резерв дилатации сосудистого русла исчерпан, то реологические параметры приобретают особое значение, поскольку высокая вязкость крови и сниженная деформируемость эритроцитов способствуют росту ОПСС, препятствуя оптимальной доставке кислорода к тканям.
Таким образом, при МС в результате гликирования белков, в частности эритроцитов, что документируется высоким содержанием HbAc1, имеют место нарушения реологических параметров крови: снижение эластичности и подвижности эритроцитов, повышение агрегационной активности тромбоцитов и вязкости крови, за счет гипергликемии и дислипидемии. Измененные реологические свойства крови способствуют росту общего периферического сопротивления на уровне микроциркуляции и в сочетании с симпатикотонией, имеющей место при МС, лежат в основе генеза АГ. Фармакологическая (бигуаниды, фибраты, статины, селективные бета-блокаторы) коррекция гликимического и липидного профилей крови, способствуют нормализации АД. Объективным критерием эффективности проводимой терапии при МС и СД является динамика HbAc1, снижение которого на 1% сопровождается статистически достоверным уменьшением риска развития сосудистых осложнений (ИМ, мозговой инсульт и др.) на 20% и более.
Фрагмент статьи А.М. Шилов, А.Ш. Авшалумов, Е.Н. Синицина, В.Б. Марковский, Полещук О.И. ММА им. И.М.Сеченова Источник: «Русский медицинский журнал», № 4 за 2008 г.